I. Tổng quan
Như chúng ta cũng đã biết, ¼ số trường hợp tử vong hàng năm ở các nước công nghiệp hóa là do tắc nghẽn mạch vành vì xơ vữa gây nhồi máu cơ tim [1]. Dù gánh nặng bệnh tật lớn như vậy, thể bệnh nhồi máu do tắc nghẽn này chỉ mới được nhận diện trong vòng 100 năm trở lại đây. Và chỉ trong vòng 50 năm, thể bệnh này đã trở thành đại dịch không lây nhiễm trên toàn cầu. Trong bài viết này, chúng tôi sẽ chia 100 năm đó thành 2 giai đoạn: nửa đầu tiên là kỷ nguyên của cholesterol và nửa sau là kỷ nguyên về LDL và statin. Bảng 1 tóm tắt những sự kiện chính yếu của cholesterol và bệnh mạch vành trong 100 năm qua. Những bằng chứng được rút ra từ những nghiên cứu thực chứng cho thấy cholesterol mang lipoprotein mật độ thấp (LDL – low-density lipoprotein) là thành phần chính của các mảng xơ vữa và một chế độ ăn giàu mỡ là nguyên do chính của tăng LDL bệnh lý.
Bảng 1. Những sự kiện chính trong thế kỷ của cholesterol và bệnh mạch vành
| Kỷ nguyên cholesterol | |
| 1910 | Mảng xơ vữa ở người có chứa cholesterol |
| 1913 | Chế độ ăn giàu cholesterol gây xơ vữa ở thỏ |
| 1919 | Ghi nhận nhồi máu cơ tim ở người |
| 1933 | Phát hiện tín hiệu ức chế tổng hợp cholesterol |
| 1938 | Mô tả tăng cholesterol máu gia đình |
| 1950 | Sáng tỏ con đường chuyển hóa cholesterol |
| 1951 | Chế độ ăn giàu mỡ làm tăng cholesterol ở người |
| 1953 | Đưa ra khái niệm yếu tố nguy cơ |
| Kỷ nguyên LDL – statin | |
| 1955 | Xác định LDL là yếu tố nguy cơ bệnh tim mạch |
| 1973 | Phát hiện thụ thể LDL |
| 1976 | Statin được khám phá |
| 1981 | Statin làm tăng số lượng thụ thể LDL |
| 1987 | Statin đầu tiên được công nhận sử dụng trên người (Mevacor) |
| 1994 | Statin làm giảm nhồi máu cơ tim và giúp kéo dài tuổi thọ |
| 1997 | Giải mã con đường SREBP |
| 2006 | PCSK9 |
II. Kỷ nguyên cholesterol
Mọi thứ khởi đầu từ năm 1910, khi một nhà giải phẫu bệnh người Đức mô tả những mảng xơ vữa trên bề mặt của động mạch chủ [2]. Adolf Widaus mô tả mảng xơ vữa này chứa cholesterol gấp 25 lần so với một động mạch chủ bình thường. Sau đó chỉ 3 năm, Nikolaj Anitschkow – một nhà khoa học Nga [3] ghi nhận nếu cho những con thỏ ăn chế độ ăn giàu cholesterol thì sẽ gây ra mảng xơ vữa. Từ tất cả những quan sát đầu tiên này làm dấy lên khả năng rằng cholesterol trong chế độ ăn là nguồn gốc của mảng xơ vữa.
Mặc dù các nhà giải phẫu bệnh nhận ra rằng động mạch vành có thể bị tắc bởi các mảng xơ vữa, thì bản thân thể bệnh này lúc đó được xem là biến cố gây tử vong trên toàn cầu. Các đợt đau ngực mà không gây tử vong thì được xem là do khó tiêu hoặc do các nguyên nhân không do tim mạch khác. Niềm tin này đã bị lay chuyển vào năm 1919 khi James Herrick – một nhà lâm sàng người Mỹ [4] dùng máy đo điện tâm đồ sơ khai ghi nhận được các thay đổi điện học ở tim những người bệnh bị đau ngực nặng mà không tử vong. Từ đây, với vai trò là một công cụ trong chẩn đoán chắc chắn các cơn đau tim, điện tâm đồ đã ngày càng được ứng dụng trong kỷ nguyên tim mạch học hiện đại.
Sau đó, mối tương quan giữa cholesterol và nhồi máu cơ tim ngày càng được chứng tỏ rõ hơn khi năm 1938, Carl Muller – nhà khoa học người Na Uy mô tả những trường hợp trong cùng 1 gia đình có nồng độ cholesterol máu rất cao do di truyền trội [5]. Thể bệnh này được đặt tên là tăng cholesterol máu gia đình (FH – familial hypercholesterolemia); có thể làm tăng 20 lần tỉ lệ nhồi máu cơ tim ở tuổi trung niên.
Quay lại năm 1933, Rudolph Schoenheimer, khi đó đang làm việc tại Đức, đã tiến hành một thí nghiệm như sau: ông cho những con chuột và trong các hũ kín, cho chúng ăn một chế độ ăn không có cholesterol và ghi nhận rằng thành phần cholesterol của thức ăn trong hũ tăng lên. Nếu chế độ ăn có cholesterol thì ông không ghi nhận chuột tiết ra thêm cholesterol nữa. Nghiên cứu bản lể này không chỉ cho thấy động vật có thể tổng hợp cholesterol, mà còn cho thấy việc tổng hợp cholesterol bị ức chế khi cholesterol có sẵn trong chế độ ăn [6]. Đây là khám phá đầu tiên về cơ chế ức chế phản hồi dựa trên sản phẩm cuối cùng trong con đường chuyển hóa, Khám phá này của Schoenheimer cũng đặt nền tảng cho việc phát hiện ra thụ thể LDL vào những năm 1970 [7] và con đường Scrap/SREBP và những năm 1990 [8].
Hình 1. Hai nhà khoa học người Đức nhận giải Nobel Y học năm 1964: Konrad Bloch và Feodor Lynen
Những năm tiếp theo, thế giới chứng kiến những tiến bộ rực rỡ trong kỷ nguyên cholesterol khi một nhóm các nhà khoa học tài ba đã tìm ra được con đường chuyển hóa phức tạp của cholesterol từ việc đa polymer hóa acetate gắn với CoA, cho đến việc tìm ra HMG-CoA là thành phần liên quan trực tiếp trên con đường tổng hợp cholesterol. Chính những phát hiện này đã mang đến giải Nobel Y học năm 1964 cho 2 nhà khoa học người Đức: Konrad Bloch và Feodor Lynen [9], [10]. Và quan trọng hơn nữa, những công trình này cũng đã xác định HMG-CoA reductase là enzyme điều hòa tốc độ tổng hợp cholesterol và có thể là một mục tiêu điều trị chính cho tăng cholesterol máu [11] (Hình 2).
Hình 2. Con đường chuyển hóa cholesterol
Năm 1951, Paul Dudley White và cộng sự của ông – Menard M. Gertler, khi đó đang là các nhà tim mạch học tại Bệnh viện đa khoa Massachusetts ở Boston, đã quan sát cẩn thận 100 người có độ tuổi dưới 40 và bị đau tim. Họ ghi nhận một loạt các yếu tố nguy cơ dẫn tới tình trạng chết người này [12], bao gồm giới nam, tăng cholesterol máu, tăng huyết áp, hút thuốc lá, tiền sử gia đình, và tạng người có khung xương to. Đến năm 1953, nhà sinh lý học người Mỹ tên Ancel Keys đã khởi động một nghiên cứu dịch tễ học đa quốc gia về đau tim. Keys đã chọn nghiên cứu 16 nhóm người nam khỏe từ những dân số cụ thể ở 7 quốc gia khác nhau [13]. Những nhóm này được chọn chủ yếu dựa trên chế độ ăn có chứa hàm lượng khác nhau của chất béo nói chung và chất béo bão hòa – từ những chế độ ăn ít béo từ nhóm ngư dân người Nhật thường chỉ ăn rau, gạo và cá; cho đến những nhóm ăn lượng lớn chất béo như những người đi rừng ở miền Đông Phần Lan có thói quen ăn bơ và phô mai. Với mỗi nhóm trong 16 nhóm này, Keys tìm hiểu kỹ lưỡng từ 511 cho đến 2.517 nam khỏe có tuổi từ 40 đến 59 tuổi và theo dõi trong vòng 10 năm để ghi lại các biến cố đau tim gây tử vong và không tử vong [13]. Ông ghi nhận rằng cholesterol máu tăng tỉ lệ với tổng lượng chất béo ăn vào (r = 0.67) và còn tăng đáng kể hơn khi so với acid béo bão hòa (r = 0.87). Các biến cố mạch vành gây tử vong tăng tỉ lệ thuận với lượng cholesterol trong máu (r = 0.80). Nồng độ cholesterol trung bình trong nhóm người Nhật là 165 mg/dL, còn trong nhóm Đông Phần Lan là 270 mg/dL. Khác biệt này dẫn đến tỉ lệ biến cố mạch vành cao hơn gấp 13 lần trong nhóm Đông Phần Lan. Tất nhiên vẫn có những yếu tố hiệu chỉnh như môi trường tại nơi sống cũng như các yếu tố về gen có thể làm hiệu chỉnh mối liên quan giữa lượng mỡ ăn vào, cholesterol máu và cơn đau tim trong dân số cụ thể. Tuy vậy, điều này không làm phủ định kết quả của Keys về việc ăn nhiều mỡ sẽ đưa đến tăng cholesterol máu và đau tim.
Từ cholesterol, năm 1955, John Gofman – một nhà khoa học người Mỹ, đã sử dụng công cụ siêu phân tách để tách các loại lipoprotein chứa cholesterol trong máu tùy theo trọng lượng phân tử [14]. Ông ghi nhận 2 dạng chính: LDL và HDL. Tiếp tục nghiên cứu máu của những bệnh nhân nhồi máu cơ tim (NMCT), ông lại phát hiện thêm là máu những người này tăng LDL đáng kể và giảm HDL đáng kể [15]. Chính phát hiện này đã được lặp đi lặp lại trên các phòng lab trên toàn thế giới, để đưa đến một mối liên quan quan trọng trong y học: đó là mối liên quan giữa LDL và NMCT. Khám phá của Gofman về mối liên quan này đã đưa tới một làn sóng hứng thú mạnh mẽ về lipoprotein xấu trên thế giới [16]. Ngược lại, khám phá của Gofman về tương quan nghịch của HDL lại ít được chú ý hơn. HDL chỉ được quan tâm trở lại 20 năm sau bởi các nhà dịch tễ học, chủ yếu qua nghiên cứu Framingham [17]. Mặc dù có rất nhiều dữ liệu về mối tương quan giữa HDL và gia tăng tần suất cơn đau tim thì vai trò của HDL trong cơ chế sinh bệnh của bệnh mạch vành còn chưa được hiểu rõ và vẫn là chủ đề tranh cãi dù đã có 40 năm nghiên cứu. Đối lập hoàn toàn với HDL, tăng nồng độ LDL máu đã được chứng minh là gây ra xơ vữa động mạch ở bất kỳ động vật có vú được nghiên cứu nào.
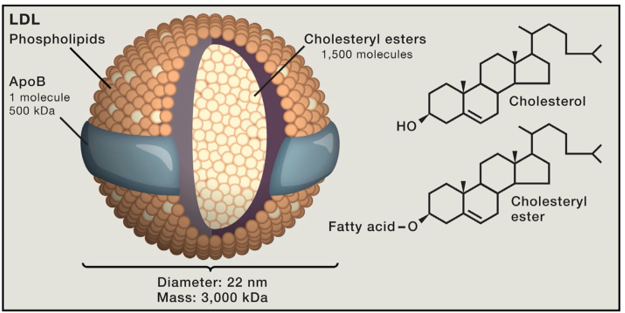
Hình 3. Cấu trúc phân tử của LDL
LDL là một cấu trúc hình cầu với đường kính 220 nm và trọng lượng khoảng 3.000 kDa. Mỗi mảnh chứa khoảng 1.500 phân tử cholesteryl ester trong một lõi ưa dầu được bọc bởi màng ưa nước chứa ~ 800 phân tử phospholipid, 500 phân tử cholesterol chưa ester hóa và một phân tử protein khoảng 500 kDa tên là apoB
Hình 3 cho thấy cấu trúc của LDL. Mỗi mảnh LDL chứa khoảng 1.500 phân tử cholesteryl ester trong một lõi kỵ nước được bao quanh là lớp áo phospholipid phân cực và một thành phần protein lớn gọi là apolipoprotein B (apoB). Một giả thuyết đáng lưu ý là LDL khởi phát tiến trình xơ vữa mạch máu khi nó xuyên qua nơi nội mạc bị hư hại vào trong thành mạch máu [18]. Sau đó LDL ở yên đó thông qua sự kết nối với các glycosaminoglycan. Phần lipid của LDL trở nên oxy hóa, và một số sản phẩm của quá trình này hiệu chỉnh phần lysine của apoB [19]. apoB hiệu chỉnh khi này được nhận diện bởi đại thực bào và được nhập bào, trở thành các tế bào bọt chứa cholesterol [20]. Các tế bào bọt này tiết ra các loại cytokines, từ đó khởi phát tiến trình viêm [11]. Khi này, các tế bào cơ trơn trong lớp nội mạc động mạch tăng sinh và sản sinh ra collagen. Mảng xơ vữa sẽ ngày càng lớn dần và đến một lúc sẽ nứt vỡ, dẫn đến hình thành cục máu đông gây tắc nghẽn mạch máu. Trong một bối cảnh đơn độc, LDL càng cao thì mảng xơ vữa càng tiến triển nhanh. Tuy vậy, LDL không tồn tại đơn độc. Ở bất kỳ nồng độ LDL máu nào, việc hình thành mảng xơ vữa còn bị ảnh hưởng bởi các yếu tố nguy cơ như hút thuốc lá, huyết áp cao, và đái tháo đường. Thêm vào đó, hiện chúng ta còn chưa biết rõ tác động của các yếu tố di truyền trên tiến trình xơ vữa mạch máu, có thể là làm thay đổi tính nhạy cảm của nội mạc khi bị tác động. Ngoại trừ những trường hợp LDL rất cao hoặc rất thấp, thì những trường hợp còn lại khó mà dự đoán chính xác khi nào một người sẽ bị đau tim.
Hành trình ban đầu để tìm ra chuyển hóa cholesterol đã trải qua rất nhiều khó khăn để cho những năm tiếp theo, sự tìm tòi và phát triển statin trở nên rực rỡ.
III. Kỷ nguyên LDL và statin
Năm 1966, một nhà khoa học người Nhật, trẻ khi đó mới 33 tuổi, tên là Akira Endo. Ông đã khởi sự một hành trình mà về sau thay đổi cuộc sống của hàng triệu người.
Endo khi đó là một nhà nghiên cứu trẻ tại công ty dược tên Sankyo (sau này đổi tên Daiichi Sankyo). Khi đó, nhiệm vụ của ông là tìm ra enzyme có trong nấm để cải thiện chất lượng của một số loại thức ăn (cụ thể là giảm tép trái cây trong nước ép). Nhưng mà như chính ông đã kể lại, vì bị hấp dẫn bởi tin giải Nobel Y học năm 1964 được trao cho việc tổng hợp cholesterol [10], nên ông trở nên hứng thú và đặt nhiều công sức chuyển qua hướng tổng hợp cholesterol cũng như các lipid khác.
Khi đó, ông xin tạm nghỉ trong 2 năm ở Sankyo, để đến New York City, làm việc tại Albert Einstein College of Medicine. Tại đây, ông bước vào thế giới lab hàng đầu thế giới, và gặp được Dr. Lawrence I. Rothfield. Chính Rothfield đã nói với Endo rằng cholesterol cao là một nguy cơ chính của bệnh tim mạch. Từ đó, 2 mối quan tâm lớn của Endo: Nấm và Cholesterol, bỗng nhiên có liên quan với nhau.
Như chúng tôi đã trình bày ở trên, bối cảnh trên thế giới những năm 1960 là Marvin D. Siperstein và Violet M. Fagan, ở Đại học Y khoa vùng Tây Nam Texas, đã khám phá ra rằng HMG-CoA enzyme chuyển hóa HMG-CoA thành tiền chất của cholesterol [11]. Chính sự kiện này đã ảnh hưởng lớn đến hướng nghiên của các nhà khoa học trên toàn thế giới. Quay trở lại với Endo, sau 2 năm tại New York, ông trở về Sankyo với một niềm cảm hứng mãnh liệt về nấm và chuyển hóa lipid. Mục tiêu mới của ông là tìm hiểu liệu ức chế HMG-CoA reductase có làm giảm nồng độ cholesterol trong máu hay không. Mặc dù khi ấy, trên thế giới cũng có nhiều người có ý nghĩ tương tự như Endo; thì Endo khác người ta ở chỗ, ông chọn rẽ qua hướng tiếp cận dựa trên nấm.
Niềm tin của Endo dựa trên giả thuyết rằng: Trong họ nhà nấm có sự cạnh tranh sinh tồn giữa các loại nấm với nhau; nếu chia nấm làm 2 nhóm: 1 nhóm cần cholesterol để sống, 1 nhóm không cần; thì nhóm không cần có lẽ phải tạo được hợp chất gì đó để tác động trên HMG-CoA reductase để cạnh tranh với nhóm cần cholesterol để sống. Đây là một giả thuyết khá mơ hồ và mông lung, nhưng nỗ lực của nhóm nghiên cứu đã mang lại kết quả.
Năm 1971, Endo và đồng nghiệp là Masao Kuroda bắt đầu hành trình tìm hợp chất ức chế tổng hợp cholesterol từ nấm bằng việc thử trên gan chuột. Trong 2 năm, và thử nghiệm trên 6000 hợp chất vi sinh, Endo và Kuroda cuối cùng đã tìm được hai chủng có tiềm năng. Đầu tiên là chủng Pythium ultimum. Loại này đạt được mục tiêu ức chế HMG-CoA reductase và giảm lượng cholesterol trên chuột, nhưng sau đó ông nhận thấy loại này rất độc với gan. Do đó, kết quả nghiên cứu này bị hủy bỏ. Loại thứ hai, may mắn hơn loại đầu tiên khi đạt được hiệu quả và an toàn, được trích ra từ Penicillium citrinum. Chúng ta có thể quen thuộc với nhóm này trong loại phô mai xanh dùng trong thực phẩm (Hình 5). Bằng việc tinh chế hợp chất hoạt động từ 2.900 lít dịch lên men lấy từ chủng P. citrinum này, Endo và Kuroda phân lập được hợp chất đặt tên là ML-236B. Chính ML-236B sau này trở thành mevastatin, với ý nghĩa là một chất làm ngưng lại (“stat” có nghĩa là dừng lại) sự tổng hợp mevalonic acid. Mevastatin hoạt động như một đồng vận cấu trúc của HMG-CoA, thuốc gắn vào enzyme HMG-CoA reductase và ngăn các sự gắn kết sau này, từ đó ức chế sự tổng hợp cholesterol [21].
Hình 5. Nấm Penicillium citrinum mọc trên những trái cam
Nguồn: Internet
Nhưng nếu dừng ở đây thì mọi công trình vẫn chưa mang lại ý nghĩa thực sự. Trong tiến trình nghiên cứu khoa học, khi tìm được một hợp chất có ý nghĩa trong phòng thí nghiệm thì lại phải tiếp tục trả lời 2 câu hỏi:
1/ Liệu mevastatin có tác dụng tương tự trên lâm sàng không, và
2/ Mevastatin có tác dụng phụ nguy hiểm nào không?
Tiếp tục trên chuột, Endo ghi nhận rằng mevastatin chỉ có hiệu quả ngắn hạn. Nếu sử dụng mevastatin lâu dài hơn, ngay cả ở liều tương đối cao, thì thuốc cũng không mang lại lợi ích lâu dài nào. Đây là một tin rất xấu, vì có thể làm sụp đổ tất cả những gì đã tìm được.
Một cách tình cờ, một đồng nghiệp của Endo gợi ý đổi đối tượng nghiên cứu sang gà mái. Ý tưởng dựa trên gà mái được củng cố bởi niềm tin rằng vì trứng gà có nhiều cholesterol nên con gà đẻ trứng có vẻ là một đối tượng hoàn hảo để thử nghiệm phương pháp giảm cholesterol này. Sau đó, Endo và cộng sự đã cho các con gà mái đẻ trứng này ăn thực phẩm bổ sung có chứa mevastatin và sau đó đo nồng độ cholesterol của chúng. Ông và cộng sự ghi nhận cholesterol giảm đến gần 50%, và trọng lượng, lượng thức ăn ăn vào cũng như khả năng đẻ trứng là không đổi [22]. Từ gà mái, cho đến thử nghiệm đầu tiên trên người và loài có vú khác đã chứng minh rằng mevastatin làm giảm đáng kể LDL-cholesterol.
Sau đó, vào tháng 4/1976, Merck, một hãng dược lớn, liên hệ Sankyo để ký kết thỏa thuận mang mevastatin về thử nghiệm. Trong 2 năm sau đó, Merck đã làm đủ mọi nghiên cứu để kiểm định là thực sự mevastatin có hiệu quả. Từ đó, các nhà khoa học tại Merck, cũng thử nghiệm trên nấm để tìm ra một loại statin khác mà Merck có thể làm chủ´quy trình sản xuất và phân phối. Trong 2 tuần, họ đã tìm ra loại statin mới, trích từ nấm Aspergillus terreus, tên là Lovastatin [23]. So với Mevastatin, Lovastatin chỉ khác 1 nhóm methyl thôi nhưng hiệu quả là tương đồng.
Cùng lúc đó thì phía Sankyo cũng tiến hành các thử nghiệm lâm sàng tiếp theo liên quan Mevastatin. Khi ấy, có một tin đồn, và cho đến nay vẫn được xem là một tin đồn, rằng một số con chó thí nghiệm khi được sử dụng mevastatin thì xuất hiện khối u ở đường tiêu hóa. Điều này dẫn đến kết quả là vào mùa thu 1980, Sankyo cho dừng tất cả các thử nghiệm liên quan đến mevastatin. Về phía Merck, vì nghe được tin này và cũng như đã nói, Lovastatin chỉ khác Mevastatin 1 nhóm methyl, nên Merch cũng ngưng các thử nghiệm trên người và rút toàn bộ mẫu thử của lovastatin về, cũng như báo cáo FDA. Tuy nhiên, Merck cũng tập trung tìm hiểu chính xác cơ chế và mức độ nguy hiểm của biến chứng này mà phía Sankyo đã gặp phải. Nhưng sau đó, dù đã bỏ rất nhiều công sức, thì họ không tìm ra bằng chứng có hại vững chắc nào; hay nói cách khác không tìm ra được mối liên quan có ý nghĩa giữa biến cố khối u đường tiêu hóa và thuốc. Lúc này, Merck không biết làm gì tiếp theo với lovastatin. Họ rơi vào tình cảnh tiến thoái lưỡng nan. Rất nhiều cuộc họp đã được đưa ra, để cuối cùng họ đã đưa đến một quyết định, mà sau này khi nhìn lại, đó là một quyết định sáng suốt.
Merck quyết định rằng, thay vì cố gắng thử nghiệm thuốc trên dân số chung, họ đưa ra ý tưởng là thử nghiệm trên một nhóm nhỏ của dân số. Đó là dân số tăng cholesterol máu gia đình dị hợp tử. Như chúng ta đã biết, đây là một bệnh lý di truyền ảnh hưởng ở 1/500 người. Người bệnh sẽ có gen bất thường làm giảm chức năng của thụ thể màng tế bào chịu trách nhiệm loại bỏ LDL trong máu. Do đó, người mắc bệnh sẽ có LDL rất cao, và thường tiến triển đến bệnh lý tim mạch ở tuổi 30 – 40 nếu không điều trị [24]. Merck mang ý tưởng này cùng tất cả dữ liệu hiện có của statin cho FDA. FDA đồng ý cho Merck khởi động thử nghiệm lại năm 1982. Và tất nhiên là nghiên cứu mang lại kết quả tốt vượt bậc với rất ít tác dụng phụ, trong đó không có tác dụng phụ ung thư đường tiêu hóa [23]. Đến năm 1987, FDA công nhận Mevacor (Lovastatin) với chỉ định sử dùng ở những bệnh nhân có mức cholesterol cao không kiểm soát được bởi chế độ ăn hoặc các thuốc khác, như thuốc ức chế tổng hợp cholesterol ở ruột.
Hình 6. Lược sử phát triển của statin cho đến đầu thế kỷ 20 [25]
Đến đây thì các nhà nghiên cứu lab có thể đã hài lòng, nhưng các nhà lâm sàng thì vẫn chưa. Vì còn một câu hỏi quan trọng nữa, đó là statin làm giảm mức LDL-cholesterol nhưng việc này có bảo vệ khỏi biến cố tim mạch hay không?
Nghiên cứu 4S (Scandinavian Simvastatin Survival Study), thực hiện năm 1994 để trả lời câu hỏi trên [26]. Trên một nhóm những bệnh nhân được chẩn đoán đau thắt ngực hoặc nhồi máu cơ tim cũ với nồng độ cholesterol toàn phần 213 – 310 mg/dL với chế độ ăn giảm lipid được phân ngẫu nhiên và 2 nhóm. 2.223 bệnh nhân được phân ngẫu nhiên nhóm giả dược và 2.221 bệnh nhân ngẫu nhiên vào nhóm simvastatin. Simvastatin là statin thế hệ thứ hai, được Merck sáng tạo dựa trên lovastatin. Kết quả của nghiên cứu 4S là một bước tiến trong tim mạch học và y khoa thực chứng: nhóm simvastatin không chỉ giảm đáng kể cholesterol toàn phần và LDL (25% và 35%), mà còn giảm 42% tỉ lệ tử vong sau 5 năm theo dõi [26]. Kết cục mạch vành chính được ghi nhận ở 622 bệnh nhân (28%) trong nhóm chứng và trong 431 bệnh nhân (19%) nhóm simvastatin (RRR 34%, p < 0,00001). Những kết quả vượt trội này từ các nghiên cứu thành công với Lovastatin đã thu hút các hãng dược khác vào cuộc đua thị trường. Sankyo cuối cùng đã kết hợp với Bristol Myes Squibb để phân phối một dẫn xuất của mevastatin với hiệu quả cao hơn. Tên của nó là Pravastatin.
Song song đó, Dr. Bruce D. Roth và cộng sự tại hãng dược Parke-Davis cũng có những thành công riêng của họ trong trích xuất dẫn xuất ức chế HMG-reductase từ một trong những lọai nấm mà Endo và Kuroda đã phân lập vài năm trước đó. Nhưng đồng thời Sandoz AG, một công ty dược Thụy Sĩ mà sau này là một phần của Novartis bây giờ, cũng đã xin cấp bằng sáng chế cho loại hợp chất tương tự. Và loại này chính là atorvastatin. Đến năm 1997, FDA công nhận atorvastatin trong điều trị trên người. Ngay sau đó, các hãng dược phẩm tiến vào cuộc đua thị trường trong sản xuất và phân phối statin. Tuy vậy, phần này không là mục tiêu của bài viết này.
Hành trình kéo dài nhiều thập kỷ của Akira Endo sau đó vẫn còn tiếp diễn. Và giữa những năm 1990, nghiên cứu U.K. Heart Protection, được bảo trợ bởi U.K Medical Research Council, British Heart Foundation, Merck và Hoffman-La Roche, được tiến hành trên 20.000 người tình nguyện tuổi từ 40 đến 80 tuổi. Những người này được xem là nhóm có nguy cơ cao bệnh tim mạch vì những yếu tố khác, như đái tháo đường. Nhưng bản thân họ không được kê đơn statin vì nồng độ LDLL-cholesterol của họ nằm trong ngưỡng bình thường. Dù vậy, nghiên cứu vẫn phân ngẫu nhiên hoặc 40 mg simvastatin hàng ngày hoặc giả dược cho những người tình nguyện và theo dõi họ trong 5,5 năm. Kết quả vô cùng ngoạn mục khi những người nhóm simvastatin có nguy cơ nhồi máu cơ tim hoặc đột quỵ giảm khoảng 20%. Những nhà khoa học dẫn đầu nghiên cứu này ước tính rằng có đến gần 20 triệu người trên thế giới có đủ tiêu chí để sử dụng statin sau nghiên cứu.
Ứng dụng lâm sàng của statin có lẽ không chỉ dừng lại ở đây. Một số nghiên cứu còn gợi ý rằng statin có thể giúp ngăn ngừa Alzheimer’s, sa sút trí tuệ, loãng xương theo tuổi và thậm chí là ung thư tiền liệt tuyến. Ngày nay khi nhìn lại, một sự tò mò về nấm của một chàng trai trẻ đã đưa đến kết quả ngoạn mục trong nỗ lực chống lại gánh nặng bệnh tật và tử vong. Có một số ý kiến cho rằng thành công của Endo chỉ là một sự “may mắn tình cờ”. Nhưng có lẽ may mắn không bao giờ đến tình cờ, nó chỉ đến với người làm việc chăm chỉ và nỗ lực tìm kiếm thành công. Akira Endo qua đời ngày 05 tháng 06 năm 2024.
IV. Kết luận
Mặc dù bệnh tim mạch do xơ vữa vẫn là nguyên nhân tử vong chính ở đa số các nước công nghiệp hóa [1] thì ở một số nước phương Tây, tử vong do bệnh tim mạch do xơ vữa hiệu chỉnh theo tuổi đã giảm khoản một nửa so với đỉnh điểm những năm 1960. Có nhiều lý do giải thích cho việc này, nhưng rõ ràng không thể không xét đến vai trò của những loại thuốc như statin, chẹn beta, aspirin, ức chế men chuyển… Tất cả những thuốc này đã có những bằng chứng ủng hộ từ các nghiên cứu lâm sàng ngẫu nhiên lớn [27]. Dù hiện tại vẫn còn nhiều điều cần làm, bao gồm cả gánh nặng bệnh tật và tử vong do xơ vữa ở những nước đang phát triển, thì các tiến bộ trong phát triển và phân phối statin vẫn là một trong những thành tựu y khoa lớn của thế kỷ trước.
Tài liệu tham khảo
- Heron M. Deaths: leading causes for 2019. 2021.
- Leibowitz JO. The history of coronary heart disease: Univ of California Press; 1970.
- Anitschkow N. Ueber experimentelle Cholesterinsteatose und ihre Bedeutehung einiger pathologischer Prozesse. Centrbl Allg Pathol Pathol Anat. 1913;24:1-9.
- Herrick JB. Thrombosis of the coronary arteries. Journal of the American Medical Association. 1919;72(6):387-90.
- Müller C. Xanthomata, hypercholesterolemia, angina pectoris. Acta Medica Scandinavica. 1938;95(S89):75-84.
- Schoenheimer R, Breusch F. Synthesis and destruction of cholesterol in the organism. 1933.
- Goldstein JL, Brown MS. The LDL receptor. Arteriosclerosis, thrombosis, and vascular biology. 2009;29(4):431-8.
- Brown MS, Goldstein JL. Cholesterol feedback: from Schoenheimer’s bottle to Scap’s MELADL. Journal of lipid research. 2009;50:S15-S27.
- Bloch K. The biological synthesis of cholesterol. Science. 1965;150(3692):19-28.
- Kuijpers P. History in medicine: The story of cholesterol, lipids and cardiology. J Cradiol Pract. 2021;19:1-5.
- Bucher NL, Overath P, Lynen F. β-Hydroxy-β-methylglutaryl coenzyme A reductase, cleavage and condensing enzymes in relation to cholesterol formation in rat liver. Biochimica et biophysica acta. 1960;40:491-501.
- Gertler MM. Coronary heart disease in young adults: a multidisciplinary study. Coronary heart disease in young adults: a multidisciplinary study1954. p. 218-.
- Keys A. Seven countries: a multivariate analysis of death and coronary heart disease: Harvard University Press; 1980.
- Gofman JW, Delalla O, Glazier F, Freeman NK, Lindgren FT, Nichols AV, et al. The serum lipoprotein transport system in health, metabolic disorders, atherosclerosis and coronary heart disease. Journal of clinical Lipidology. 2007;1(2):104-41.
- Gofman JW, Rubin L, McGinley JP, Jones HB. Hyperlipoproteinemia. The American journal of medicine. 1954;17(4):514-20.
- Fredrickson DS, Levy RI, Lees RS. Fat transport in lipoproteins—an integrated approach to mechanisms and disorders. New England Journal of Medicine. 1967;276(3):148-56.
- Gordon T, Castelli WP, Hjortland MC, Kannel WB, Dawber TR. High density lipoprotein as a protective factor against coronary heart disease: the Framingham Study. The American journal of medicine. 1977;62(5):707-14.
- Bonetti PO, Lerman LO, Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk. Arteriosclerosis, thrombosis, and vascular biology. 2003;23(2):168-75.
- Steinberg D, Witztum JL. Oxidized low-density lipoprotein and atherosclerosis. Arteriosclerosis, thrombosis, and vascular biology. 2010;30(12):2311-6.
- Brown MS, Goldstein JL. Lipoprotein metabolism in the macrophage: implications for cholesterol deposition in atherosclerosis. Annual review of biochemistry. 1983;52(1):223-61.
- Istvan ES, Deisenhofer J. Structural mechanism for statin inhibition of HMG-CoA reductase. Science. 2001;292(5519):1160-4.
- Endo A. The discovery and development of the statins. Statins: CRC Press; 1999. p. 58-74.
- Krukemyer JJ, Talbert RL. Lovastatin: A new cholesterol‐lowering agent. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 1987;7(6):198-209.
- Yuan G, Wang J, Hegele RA. Heterozygous familial hypercholesterolemia: an underrecognized cause of early cardiovascular disease. Cmaj. 2006;174(8):1124-9.
- Tobert JA. Lovastatin and beyond: the history of the HMG-CoA reductase inhibitors. Nature Reviews Drug Discovery. 2003;2(7):517-26.
- Kjekshus J, Pedersen TR, Group SSSS. Reducing the risk of coronary events: evidence from the Scandinavian Simvastatin Survival Study (4S). The American journal of cardiology. 1995;76(9):64C-8C.
- Yusuf S. Two decades of progress in preventing vascular disease. The Lancet. 2002;360(9326):2-3.